专访|哈工大团队详解微纳机器人如何首次主动靶向脑胶质瘤
2021-08-06 21:53:51 作者:佚名
“常规的药物递送手段,比如打针或者吃药等方法,都是药物分子或药物载体在血液或其他生物流体中扩散完成的,这会导致药物在病患区域的有效剂量低,而且毒副作用大。”近日,哈尔滨工业大学微纳米技术研究中心贺强与吴志光教授在接受澎湃新闻(www.thepaper.cn)记者专访时表示,为解决上述问题,他们致力于开发能够进行自主运动的游动微纳米机器人。
 贺强率领的研究团队近期在《科学机器人》(Science Robotics)上在线发表了一项在微纳机器人领域备受关注的研究,该研究题为“双响应生物杂化中性粒细胞机器人用于主动靶向递送”(Dual-responsive biohybrid neutrobots for active target delivery),他们首次实现了游动微纳米机器人对脑胶质瘤的主动靶向治疗。
贺强率领的研究团队近期在《科学机器人》(Science Robotics)上在线发表了一项在微纳机器人领域备受关注的研究,该研究题为“双响应生物杂化中性粒细胞机器人用于主动靶向递送”(Dual-responsive biohybrid neutrobots for active target delivery),他们首次实现了游动微纳米机器人对脑胶质瘤的主动靶向治疗。
贺强与吴志光为论文共同通讯作者,哈工大2016级博士生张红玥为论文第一作者。该研究受到国家自然科学基金和黑龙江省自然科学优秀青年基金等项目资助。
贺强于2010年加入哈尔滨工业大学微纳米技术研究中心,组建了国内首个游动纳米机器人研究团队。2011 年入选教育部新世纪优秀人才计划,2012 年入选龙江学者特聘教授。贺强也是吴志光的博士生导师,吴志光在2015年博士毕业后,一直在贺强团队工作。
吴志光长期致力于面向主动递送的游动微纳米机器人研究,曾作为洪堡学者与博士后赴德国马普智能系统研究所与美国加州理工学院进行研究工作,2019年获聘哈工大青年拔尖教授。其曾入选2019年麻省理工科技评论“35位35岁以下科技创新人才”(MIT TR35)中国榜单,是目前微纳机器人研究领域国内单位唯一入选者。当时入选理由为:他打造的微纳机器人,可穿越多道生物屏障将药物精准送达病患处。
“游动微纳米机器人因其具有额外的自推进游动能力,可以主动游动把药物递送到病患区域。”贺强表示,这种游动微纳米机器人不仅只是针对胶质瘤,更是一个脑部治疗平台,“在不久的将来会让游动微纳米机器人运输更多诊疗药物,治疗范围拓展到癫痫、中风偏瘫等其他脑部疾病。”
《科学机器人》还发表了同期焦点文章介绍该成果。韩国大邱庆北科学技术院(DGIST)、韩国大邱庆北科学技术院-瑞士苏黎世联邦理工学院(DGIST-ETH)微型机器人研究中心的Hongsoo Choi教授等人在撰文中评价道,贺强教授研究团队的工作在体内克服了生物屏障实现靶向递送治疗药物,“可视作微型机器人概念的一个有价值的证明。”
Hongsoo Choi等人同时强调,“通过神经机器人或微型机器人实现从实验室到临床的靶向药物传递仍有一段路要走。”贺强也对澎湃新闻(www.thepaper.cn)记者表示,下一步将开展更深层次的研究,例如游动微纳米机器人趋向集群运动的特征、机理与调控方法,游动微纳米机器人在活体内集群运动控制研究。在技术应用方面,则会进行更多活体动物研究,例如猪等。
“希望在接下来的几年里完成游动微纳米机器人治疗胶质瘤的技术转化,为社会做出贡献。”贺强表示。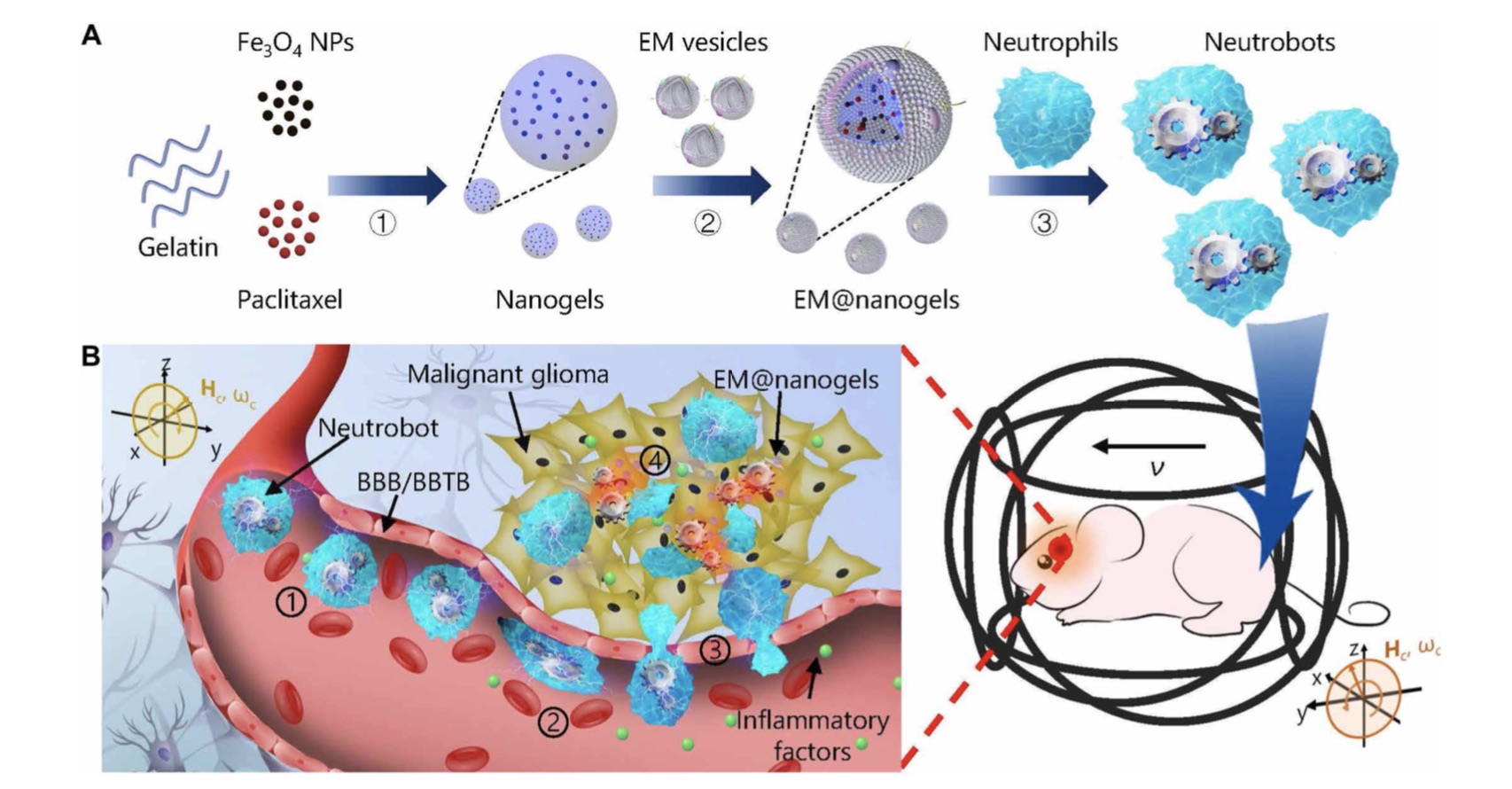
常规的药物递送方式例如口服或注射主要依靠药物分子或载体血液循环运输完成,这种被动扩散方法通常受到多重生物屏障的阻碍。这不但导致有效剂量严重不足,同时也容易引发全身性的毒副作用,难以完成精准药物递送的需求。
此前有研究对近30年来的药物递送方式进行了统计。结果显示,递送约12个小时后,最高的递送效率还不到1%。因此,新型主动药物递送方式既必要又重要。
那么,能不能开发出主动的游动纳米机器人,装载药物在人体内游走,将药物递送给病患区域内来治疗疾病?实际上,早在上世纪60年代的电影里,即有医疗工作者被缩小到微纳米尺寸,然后再被注射到一位科学家体内,直接游到病患区进行治疗。
这样的故事在本世纪初开始接近现实。贺强对澎湃新闻记者介绍道,自2004年起,科学家通过模仿细菌和精子等天然微生物以及生物分子马达的方法,设计并构筑出多种依靠化学、光、磁以及超声驱动的游动微纳米机器人。这些微纳米机器人不但可以在水或其他生物流体中进行高效游动,并且可借助化学、光、磁等方式来控制它们的运动行为,使它们按照人们的意愿抵达指定的位置。
然而,面对实际生物医学应用,游动微纳机器人在生物相容性、生物降解性、复杂生物环境内的控制等方面仍然面临着挑战。例如游动微纳米机器人因其外源性质,在进入体内后会受到免疫系统的攻击。更重要的是,这些游动微纳米机器人无法在体内复杂环境中精确地寻找到炎症位点并且难以突破诸如血脑屏障等生物屏障。
“我们知道,人体内环境不仅仅是水,它是非常复杂的,尤其是人体内有多种生物屏障,这些生物屏障保护人体,防止外源的细菌和病毒侵入,但也阻碍了游动微纳米机器人向病患区域的递送。”
吴志光以眼底视网膜举例,即存在血-房水屏障、血-视网膜屏障、玻璃体屏障等,“一直以来科学家想设计游动微纳米机器人来突破生物屏障或者生物组织,结果发现,尽管以前的游动微纳米机器人可以在水中游动,但是在生物屏障或生物组织中还是无法成功。”
吴志光对澎湃新闻(www.thepaper.cn)进一步解释道,造成游动微纳米机器人无法突破生物屏障的主要难点在于生物屏障微观三维网格的空间阻碍以及生物大分子对游动微纳机器人的黏附作用(分子阻碍)。
“对于这两个问题,我们一一解决,首先为了解决空间阻碍问题,我们制备了一种头部尺寸比玻璃体三维网格尺寸还小的结构,然后为了防止生物单分子的粘附,我们在游动微纳米机器人涂抹了液态润滑层,这种润滑层是受自然界猪笼草的表面结构启发的。”
结合这两种方式,吴志光等人首次实现了游动微纳米机器人在玻璃体中的可控游动。此前的2018年,国际学术期刊《科学进展》(Science Advances)在线发表了吴志光等人的研究成果,首次提出了直径仅为500纳米、表面涂覆纳米液态润滑层的螺旋形磁性纳米机器人。
“上一次解决了眼科生物屏障,这次我们把目标聚焦到了另一个非常重要的屏障,也就是血脑屏障(BBB),同时也开展了针对具体疾病的治疗研究,就是胶质瘤的主动递送治疗中。”吴志光表示。
首次实现对脑胶质瘤的主动靶向治疗
胶质母细胞瘤(GBM)是颅内最常见的恶性原发肿瘤,也是最难有效治疗的癌症之一,患者总体生存期短,长期生存者罕见。在全球范围内,中国的胶质母细胞瘤发病率及死亡人数均占首位,重要原因之一是缺乏精准疗法,而且由于血脑屏障和血肿瘤屏障的存在,进入颅内肿瘤部位的治疗途径也有限。
贺强等人提到,如何让药物突破血脑屏障,实现药物的主动靶向递送,提高药物对胶质瘤的疗效,成为胶质瘤医疗领域长久以来的瓶颈难题。“针对此瓶颈问题,我们开发了这种一种游动微纳米机器人(Neutrobot)。”
实际上,在过去的十几年里,科学家在将各种生物细胞(如精子和血细胞)和微生物(如细菌和藻类)与合成的微观结构相结合方面取得了显著的进展。Hongsoo Choi等人提到,细胞和微生物在本质上通常具有独特的特性,如生物相容性、生物降解性和可变形性,这些特性可以用来增强微型机器人在体内的应用。
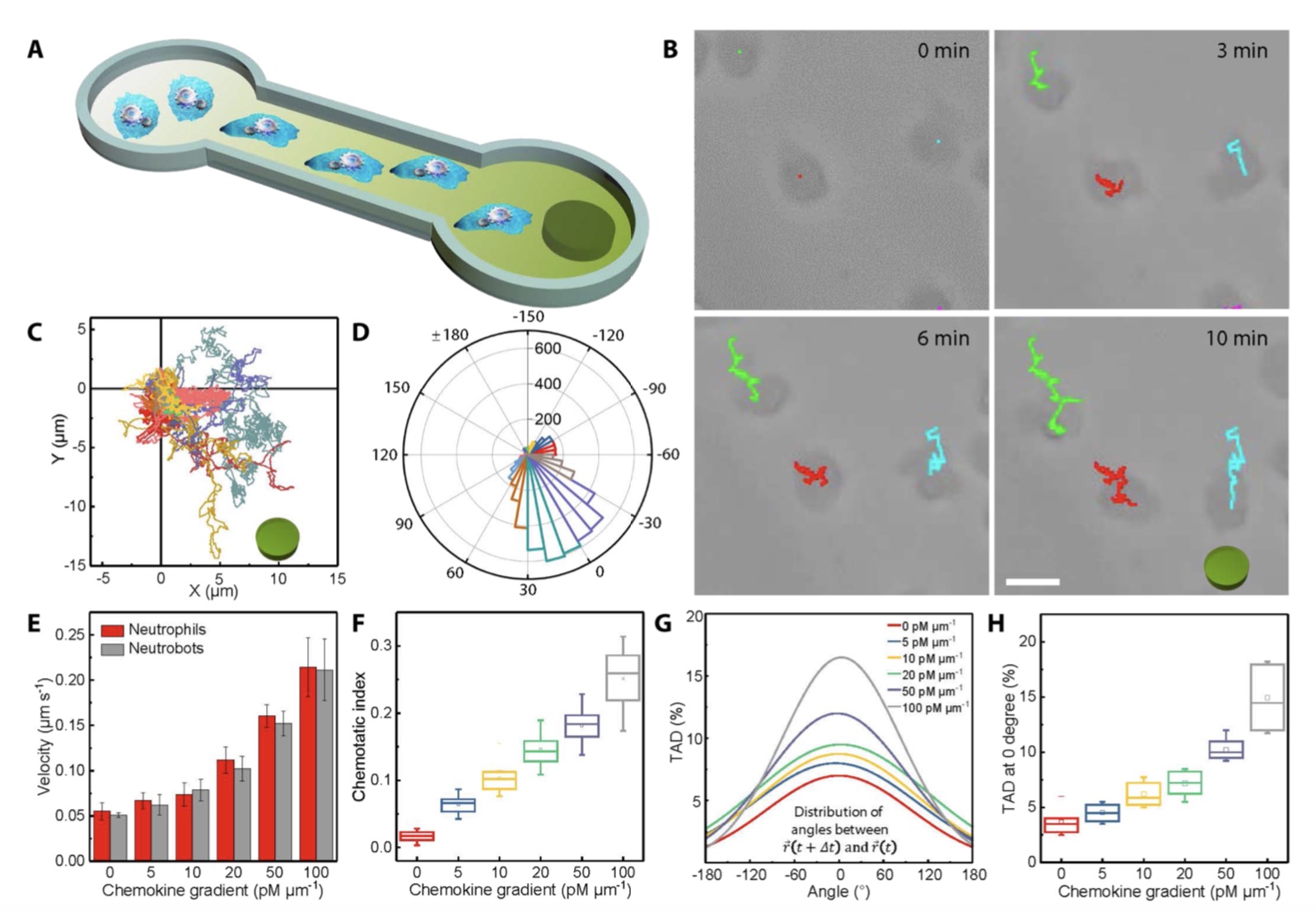
其中,白细胞中的一种,即嗜中性粒细胞,是免疫系统中的重要组成部分,已知能够穿过生物屏障,同时不触发科学家们不希望看到的免疫反应。此外,经过上亿年的进化,嗜中性粒细胞发展出对炎症因子的趋向能力。贺强等人指出,其可沿着炎症因子的梯度游动最终寻找到病患位置。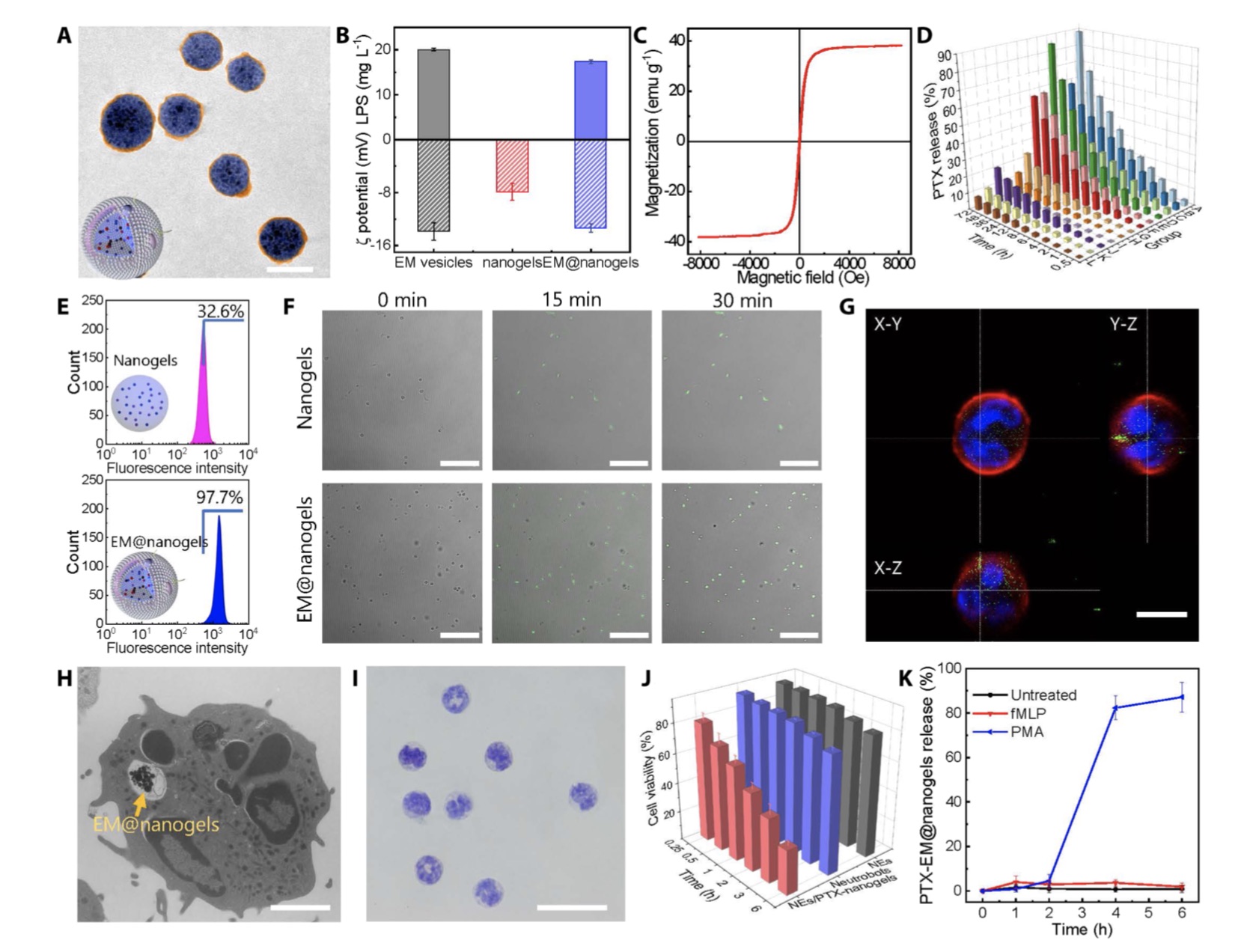
值得注意的是,该研究中的大肠杆菌膜相当于给磁性载药水凝胶披上了“伪装”外衣,从而提高中性细胞对磁性载药粒子的吞噬量,实现了在外源磁场下的驱动。该策略还提高了该游动微纳米机器人的生物相容性,也防止了磁性纳米凝胶中所载药物的泄漏。
“这些研究结果确立了游动微纳米机器人作为一种潜在的脑渗透精准疗法,用于系统性治疗胶质瘤。”贺强同时强调,这种游动微纳米机器人不仅只是针对胶质瘤,更是一个脑部治疗平台,“在不久的将来会让游动微纳米机器人运输更多诊疗药物,治疗范围拓展到癫痫、中风偏瘫等其他脑部疾病。”
在这项最新的研究中,贺强等人还进行了相关的活体动物胶质瘤治疗研究。他们将中性粒细胞机器人注射到小鼠体内,通过外源磁场的控制引导以及光学通断层扫描,可以操纵中性粒细胞微机器人富集到脑部,到达脑部的中性粒细胞机器人依靠其趋向功能,沿胶质瘤释放出的炎症因子穿越血脑屏障,最终抵达胶质瘤病患区域并将药物释放。
研究结果显示,经过中性粒细胞治疗的胶质瘤小鼠可延长其存活周期一倍以上,这为以后纳米机器人的靶向药物运输提供了研究基础。这也是首次实现游动微纳米机器人对脑胶质瘤的主动靶向治疗。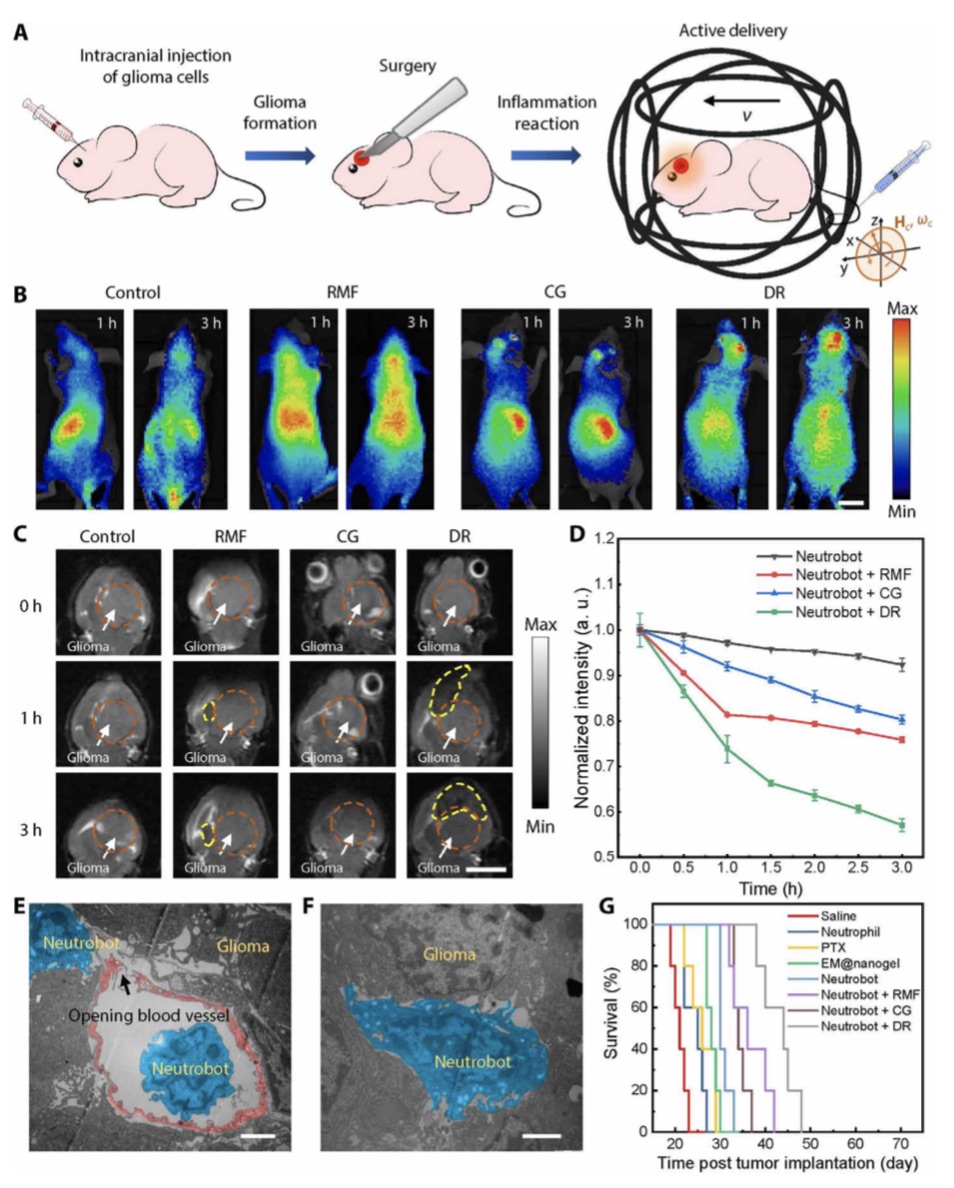
医疗微纳机器人临床应用处于什么阶段?贺强对澎湃新闻记者表示,经过十几年游动微纳米机器人的研究,目前它在生物医疗领域研究已经达到了一个相对比较高的水平,攻克了很多挑战问题。
“我们的这项研究已经实现针对胶质瘤在活体动物内的主动药物递送,并且取得了比较良好的效果,但距离完全转化仍然还有一些问题。”吴志光补充道,例如,游动微纳米机器人集群在活体动物内的成像还是不容易,“第一,游动微纳米机器人尺寸过小,低于临床医疗成像技术分辨率;第二,游动微纳米机器人与生物组织在生物影响下的对比度不够大。”
“当然,其实最大的问题还是缺钱和人,希望有更多的人才参与和涌入到这项研究中。”吴志光坦言。
Hongsoo Choi等人在文章中也同样指出,通过神经机器人或微型机器人实现从实验室到临床的靶向药物传递仍有一段路要走。他们提到,目前的体内荧光和磁共振成像系统由于有限的时空分辨率和深度分辨率,均无法提供关于游动微纳米机器人的位置或到目标位置的导航路径的实时信息。
Hongsoo Choi等人认为,从临床实践的角度来看,微机器人的实时可视化和导航路径是体内成功靶向药物治疗的必要条件。此外,还需要继续努力开发具有大工作空间的磁控制系统,该系统可以容纳人体尺度的物体,并产生足够强的旋转磁场,用于微型机器人的磁驱动。
“我们希望这些目标将在不久的将来被研究人员实现。”Hongsoo Choi等人表示。
贺强等人也致力于将该项研究最终推向临床。“下一步将开展更深层次的研究,例如游动微纳米机器人趋向集群运动的特征、机理与调控方法,游动微纳米机器人在活体内集群运动控制研究。”贺强表示。
在临床转化之前,他们还将在更多动物模型上验证该技术应用的潜力。
论文链接:https://robotics.sciencemag.org/content/6/52/eaaz9519(本文来自澎湃新闻,更多原创资讯请下载“澎湃新闻”APP)
 贺强率领的研究团队近期在《科学机器人》(Science Robotics)上在线发表了一项在微纳机器人领域备受关注的研究,该研究题为“双响应生物杂化中性粒细胞机器人用于主动靶向递送”(Dual-responsive biohybrid neutrobots for active target delivery),他们首次实现了游动微纳米机器人对脑胶质瘤的主动靶向治疗。
贺强率领的研究团队近期在《科学机器人》(Science Robotics)上在线发表了一项在微纳机器人领域备受关注的研究,该研究题为“双响应生物杂化中性粒细胞机器人用于主动靶向递送”(Dual-responsive biohybrid neutrobots for active target delivery),他们首次实现了游动微纳米机器人对脑胶质瘤的主动靶向治疗。
贺强与吴志光为论文共同通讯作者,哈工大2016级博士生张红玥为论文第一作者。该研究受到国家自然科学基金和黑龙江省自然科学优秀青年基金等项目资助。
贺强于2010年加入哈尔滨工业大学微纳米技术研究中心,组建了国内首个游动纳米机器人研究团队。2011 年入选教育部新世纪优秀人才计划,2012 年入选龙江学者特聘教授。贺强也是吴志光的博士生导师,吴志光在2015年博士毕业后,一直在贺强团队工作。
吴志光长期致力于面向主动递送的游动微纳米机器人研究,曾作为洪堡学者与博士后赴德国马普智能系统研究所与美国加州理工学院进行研究工作,2019年获聘哈工大青年拔尖教授。其曾入选2019年麻省理工科技评论“35位35岁以下科技创新人才”(MIT TR35)中国榜单,是目前微纳机器人研究领域国内单位唯一入选者。当时入选理由为:他打造的微纳机器人,可穿越多道生物屏障将药物精准送达病患处。
“游动微纳米机器人因其具有额外的自推进游动能力,可以主动游动把药物递送到病患区域。”贺强表示,这种游动微纳米机器人不仅只是针对胶质瘤,更是一个脑部治疗平台,“在不久的将来会让游动微纳米机器人运输更多诊疗药物,治疗范围拓展到癫痫、中风偏瘫等其他脑部疾病。”
《科学机器人》还发表了同期焦点文章介绍该成果。韩国大邱庆北科学技术院(DGIST)、韩国大邱庆北科学技术院-瑞士苏黎世联邦理工学院(DGIST-ETH)微型机器人研究中心的Hongsoo Choi教授等人在撰文中评价道,贺强教授研究团队的工作在体内克服了生物屏障实现靶向递送治疗药物,“可视作微型机器人概念的一个有价值的证明。”
Hongsoo Choi等人同时强调,“通过神经机器人或微型机器人实现从实验室到临床的靶向药物传递仍有一段路要走。”贺强也对澎湃新闻(www.thepaper.cn)记者表示,下一步将开展更深层次的研究,例如游动微纳米机器人趋向集群运动的特征、机理与调控方法,游动微纳米机器人在活体内集群运动控制研究。在技术应用方面,则会进行更多活体动物研究,例如猪等。
“希望在接下来的几年里完成游动微纳米机器人治疗胶质瘤的技术转化,为社会做出贡献。”贺强表示。

双响应生物杂化中性粒细胞机器人体内主动治疗原理图。
兼具外源磁场控制与沿炎症因子趋向运动的游动微纳米机器人突破血脑屏障,最终将药物递送到小鼠病灶。 研究团队提供(00:44) 穿越血脑屏障的微纳机器人常规的药物递送方式例如口服或注射主要依靠药物分子或载体血液循环运输完成,这种被动扩散方法通常受到多重生物屏障的阻碍。这不但导致有效剂量严重不足,同时也容易引发全身性的毒副作用,难以完成精准药物递送的需求。
此前有研究对近30年来的药物递送方式进行了统计。结果显示,递送约12个小时后,最高的递送效率还不到1%。因此,新型主动药物递送方式既必要又重要。
那么,能不能开发出主动的游动纳米机器人,装载药物在人体内游走,将药物递送给病患区域内来治疗疾病?实际上,早在上世纪60年代的电影里,即有医疗工作者被缩小到微纳米尺寸,然后再被注射到一位科学家体内,直接游到病患区进行治疗。
这样的故事在本世纪初开始接近现实。贺强对澎湃新闻记者介绍道,自2004年起,科学家通过模仿细菌和精子等天然微生物以及生物分子马达的方法,设计并构筑出多种依靠化学、光、磁以及超声驱动的游动微纳米机器人。这些微纳米机器人不但可以在水或其他生物流体中进行高效游动,并且可借助化学、光、磁等方式来控制它们的运动行为,使它们按照人们的意愿抵达指定的位置。
然而,面对实际生物医学应用,游动微纳机器人在生物相容性、生物降解性、复杂生物环境内的控制等方面仍然面临着挑战。例如游动微纳米机器人因其外源性质,在进入体内后会受到免疫系统的攻击。更重要的是,这些游动微纳米机器人无法在体内复杂环境中精确地寻找到炎症位点并且难以突破诸如血脑屏障等生物屏障。
“我们知道,人体内环境不仅仅是水,它是非常复杂的,尤其是人体内有多种生物屏障,这些生物屏障保护人体,防止外源的细菌和病毒侵入,但也阻碍了游动微纳米机器人向病患区域的递送。”
吴志光以眼底视网膜举例,即存在血-房水屏障、血-视网膜屏障、玻璃体屏障等,“一直以来科学家想设计游动微纳米机器人来突破生物屏障或者生物组织,结果发现,尽管以前的游动微纳米机器人可以在水中游动,但是在生物屏障或生物组织中还是无法成功。”
吴志光对澎湃新闻(www.thepaper.cn)进一步解释道,造成游动微纳米机器人无法突破生物屏障的主要难点在于生物屏障微观三维网格的空间阻碍以及生物大分子对游动微纳机器人的黏附作用(分子阻碍)。
“对于这两个问题,我们一一解决,首先为了解决空间阻碍问题,我们制备了一种头部尺寸比玻璃体三维网格尺寸还小的结构,然后为了防止生物单分子的粘附,我们在游动微纳米机器人涂抹了液态润滑层,这种润滑层是受自然界猪笼草的表面结构启发的。”
结合这两种方式,吴志光等人首次实现了游动微纳米机器人在玻璃体中的可控游动。此前的2018年,国际学术期刊《科学进展》(Science Advances)在线发表了吴志光等人的研究成果,首次提出了直径仅为500纳米、表面涂覆纳米液态润滑层的螺旋形磁性纳米机器人。
“上一次解决了眼科生物屏障,这次我们把目标聚焦到了另一个非常重要的屏障,也就是血脑屏障(BBB),同时也开展了针对具体疾病的治疗研究,就是胶质瘤的主动递送治疗中。”吴志光表示。
首次实现对脑胶质瘤的主动靶向治疗
胶质母细胞瘤(GBM)是颅内最常见的恶性原发肿瘤,也是最难有效治疗的癌症之一,患者总体生存期短,长期生存者罕见。在全球范围内,中国的胶质母细胞瘤发病率及死亡人数均占首位,重要原因之一是缺乏精准疗法,而且由于血脑屏障和血肿瘤屏障的存在,进入颅内肿瘤部位的治疗途径也有限。
贺强等人提到,如何让药物突破血脑屏障,实现药物的主动靶向递送,提高药物对胶质瘤的疗效,成为胶质瘤医疗领域长久以来的瓶颈难题。“针对此瓶颈问题,我们开发了这种一种游动微纳米机器人(Neutrobot)。”
实际上,在过去的十几年里,科学家在将各种生物细胞(如精子和血细胞)和微生物(如细菌和藻类)与合成的微观结构相结合方面取得了显著的进展。Hongsoo Choi等人提到,细胞和微生物在本质上通常具有独特的特性,如生物相容性、生物降解性和可变形性,这些特性可以用来增强微型机器人在体内的应用。
其中,白细胞中的一种,即嗜中性粒细胞,是免疫系统中的重要组成部分,已知能够穿过生物屏障,同时不触发科学家们不希望看到的免疫反应。此外,经过上亿年的进化,嗜中性粒细胞发展出对炎症因子的趋向能力。贺强等人指出,其可沿着炎症因子的梯度游动最终寻找到病患位置。

双响应生物杂化中性粒细胞机器人的制备与表征。
“因此我们设想如果我们能够用天然中性粒细胞做成一种游动微纳米机器人,那么这种微米机器人能够躲避免疫系统的攻击,并且自动游动到病患区域了。”据介绍,哈工大研究团队自2016年开始,即针对如何实现中性粒细胞杂化的游动微米机器人进行了大量尝试。最终设计出一种可高效装载多种药物,并且兼具外源磁场控制与沿炎症因子趋向运动的中性粒细胞机器人。
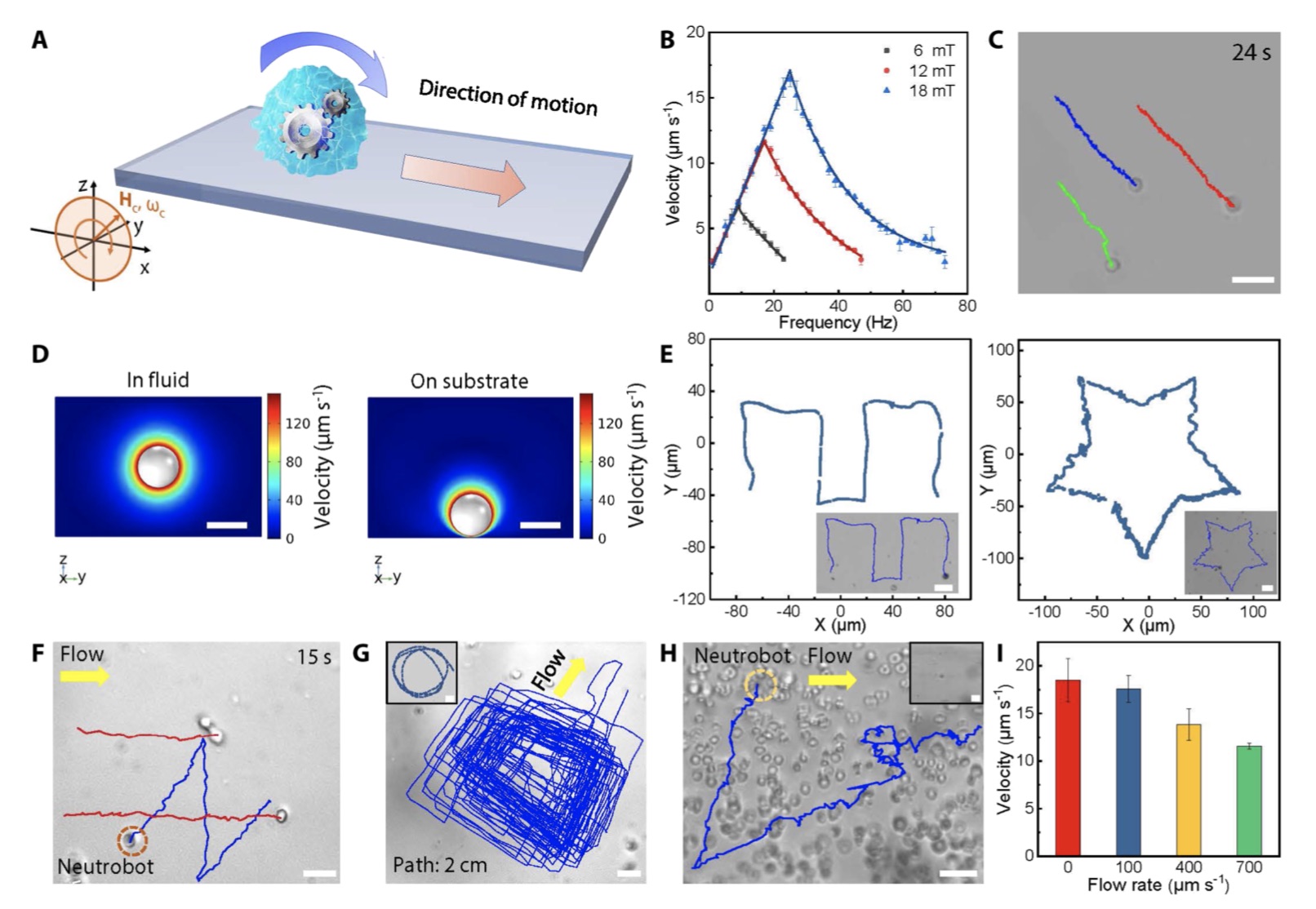
可控磁驱动的中性粒细胞机器人。
贺强介绍,这种游动微纳米机器人通过中性粒细胞吞噬大肠杆菌膜包裹的磁性载药水凝胶制备而成,可有效且稳定地携带紫杉醇等抗癌药物。依靠自研发的外源磁场控制系统,可将游动微纳米机器人引导到脑部区域,抵达脑部区域的机器人可根据脑内病原信号自动游动到病患位点,在脑内微环境的作用下将药物精准地释放到病患处。
趋化因子梯度上下中性粒细胞机器人趋化动力学。
Hongsoo Choi等人评价道,该研究中的磁场以非侵入性的方式安全地穿透生物组织,使微型机器人能够在体内进行主动控制。值得注意的是,该研究中的大肠杆菌膜相当于给磁性载药水凝胶披上了“伪装”外衣,从而提高中性细胞对磁性载药粒子的吞噬量,实现了在外源磁场下的驱动。该策略还提高了该游动微纳米机器人的生物相容性,也防止了磁性纳米凝胶中所载药物的泄漏。
“这些研究结果确立了游动微纳米机器人作为一种潜在的脑渗透精准疗法,用于系统性治疗胶质瘤。”贺强同时强调,这种游动微纳米机器人不仅只是针对胶质瘤,更是一个脑部治疗平台,“在不久的将来会让游动微纳米机器人运输更多诊疗药物,治疗范围拓展到癫痫、中风偏瘫等其他脑部疾病。”
在这项最新的研究中,贺强等人还进行了相关的活体动物胶质瘤治疗研究。他们将中性粒细胞机器人注射到小鼠体内,通过外源磁场的控制引导以及光学通断层扫描,可以操纵中性粒细胞微机器人富集到脑部,到达脑部的中性粒细胞机器人依靠其趋向功能,沿胶质瘤释放出的炎症因子穿越血脑屏障,最终抵达胶质瘤病患区域并将药物释放。
研究结果显示,经过中性粒细胞治疗的胶质瘤小鼠可延长其存活周期一倍以上,这为以后纳米机器人的靶向药物运输提供了研究基础。这也是首次实现游动微纳米机器人对脑胶质瘤的主动靶向治疗。

中性粒细胞微机器人向术后胶质瘤主动递送。
完全转化尚有一段距离医疗微纳机器人临床应用处于什么阶段?贺强对澎湃新闻记者表示,经过十几年游动微纳米机器人的研究,目前它在生物医疗领域研究已经达到了一个相对比较高的水平,攻克了很多挑战问题。
“我们的这项研究已经实现针对胶质瘤在活体动物内的主动药物递送,并且取得了比较良好的效果,但距离完全转化仍然还有一些问题。”吴志光补充道,例如,游动微纳米机器人集群在活体动物内的成像还是不容易,“第一,游动微纳米机器人尺寸过小,低于临床医疗成像技术分辨率;第二,游动微纳米机器人与生物组织在生物影响下的对比度不够大。”
“当然,其实最大的问题还是缺钱和人,希望有更多的人才参与和涌入到这项研究中。”吴志光坦言。
Hongsoo Choi等人在文章中也同样指出,通过神经机器人或微型机器人实现从实验室到临床的靶向药物传递仍有一段路要走。他们提到,目前的体内荧光和磁共振成像系统由于有限的时空分辨率和深度分辨率,均无法提供关于游动微纳米机器人的位置或到目标位置的导航路径的实时信息。
Hongsoo Choi等人认为,从临床实践的角度来看,微机器人的实时可视化和导航路径是体内成功靶向药物治疗的必要条件。此外,还需要继续努力开发具有大工作空间的磁控制系统,该系统可以容纳人体尺度的物体,并产生足够强的旋转磁场,用于微型机器人的磁驱动。
“我们希望这些目标将在不久的将来被研究人员实现。”Hongsoo Choi等人表示。
贺强等人也致力于将该项研究最终推向临床。“下一步将开展更深层次的研究,例如游动微纳米机器人趋向集群运动的特征、机理与调控方法,游动微纳米机器人在活体内集群运动控制研究。”贺强表示。
在临床转化之前,他们还将在更多动物模型上验证该技术应用的潜力。
论文链接:https://robotics.sciencemag.org/content/6/52/eaaz9519(本文来自澎湃新闻,更多原创资讯请下载“澎湃新闻”APP)











