构建首个体外人囊胚模型!人类胚胎早期发育“黑盒”打开了?
2021-08-06 21:52:27 作者:佚名
生命科学发展至今,人类胚胎的早期发育过程仍然是一个“黑盒”——我们对其知之甚少。然而,在严格的生物伦理等限制面前,如何解密这个生命之初的“黑盒”,让科学家们束手无策。
北京时间3月18日凌晨,国际顶级学术期刊《自然》(Nature)在线发表了两篇论文,描述了两种在实验室条件下生成的人囊胚样结构。
美国密歇根大学安娜堡分校傅建平等人在《自然》同期刊发的观点文章中点评:“这是第一个完整的人类胚胎模型,含有与胎儿及其支持组织的所有初始细胞谱系相关的细胞类型。”他们认为,利用体外培养的细胞构建哺乳动物胚胎模型技术为探索生命奥秘带来了令人兴奋的机遇。
 两篇论文分别题为“Blastocyst-like structures generated from human pluripotent stem cells” 、“Modelling human blastocysts by reprogramming fibroblasts into iBlastoids”。
两篇论文分别题为“Blastocyst-like structures generated from human pluripotent stem cells” 、“Modelling human blastocysts by reprogramming fibroblasts into iBlastoids”。
第一项研究由美国得克萨斯大学西南医学中心和中国的五邑大学、昆明医科大学等团队的研究人员联合完成,通讯作者为得克萨斯大学西南医学中心助理教授Gary C. Hon和吴军。
第二项研究由澳大利亚莫纳什大学、杜克-新加坡国立大学医学院、美国加州大学洛杉矶分校等团队的研究人员联合完成,通讯作者为莫纳什大学解剖与发育生物学系教授Jose M. Polo。
吴军在接受澎湃新闻(www.thepaer.cn)记者专访时表示,“目前我们对于胚胎发育的了解,大多是还是来自于对各种模式生物的研究,比如小鼠等。这主要是因为两点:一、使用胚胎进行研究,涉及很多伦理问题。二、能够用于研究的人类胚胎主要来自于采取人工授精治疗后的夫妇,将多余的胚胎捐赠用于研究。”
然而,这些稀有的胚胎数量,远远达不到进行深入研究的需求。吴军认为,“如果能够在体外获得一种类似于人类胚胎的结构,这将同时解决上述的两个问题,使科学家们更加广泛深入的研究人类早期胚胎发育变为可能。”
傅建平等人在观点文章中写道:如果我们要改进辅助生殖技术、防止怀孕失败和出生缺陷,对早期人类发育的正确理解是至关重要的。然而,研究早期发育是一个挑战——几乎没有人类胚胎可用,而且研究受到相当大的伦理和法律限制。他们认为上述两项研究在这一领域取得了重大进展。
不过值得注意的是,上述两个研究团队均强调,他们在体外构建的模型“不应该被认为等同于人类囊胚”。吴军对澎湃新闻记者表示,“我们必须强调一点,我们研究的并不是真正的胚胎。”他总结道,从生物学角度,这个结构的本质并不是胚胎,只是一个可以经历胚胎早期发育过程的胚胎干细胞的集合体。
人类早期胚胎发育理解受限
包括人类在内的哺乳动物胚胎的发生始于一个全能受精卵,逐渐发育成桑葚胚,然后形成囊胚。囊胚的外胚层(EPI)细胞将发育为胚体和羊膜,而滋养外胚层(TE)细胞和原始内胚层(PE)细胞则最终分别发育为胎盘和卵黄囊。
Polo等人在论文中提到,科学家在体外培养时,可以用外胚层细胞生成人类胚胎干细胞(hES)。另外,也可以通过转录因子介导将成体细胞重编程成人类诱导多能干细胞(hiPS)细胞。这些多能细胞可以分化成身体的所有细胞类型,并已被用于开发体外模型,以研究早期人类发育。
然而,这些简单的干细胞模型虽然对人类多能性的遗传和表观遗传学提供了前所未有的见解,但它们对发生在囊胚和着床前后的人类胚胎发育过程中复杂的时空分子变化提供的信息有限。
Polo等人提到,目前,研究这一问题的唯一方法是将体外受精后捐赠囊胚的研究信息结合起来。但出于研究目的而使用人类囊胚还存在着很多的伦理、政策和技术限制,“这些限制共同限制了我们对早期人类胚胎发育的理解。”
值得一提的是,此前,已有其他实验室生成了名为“Blastoids”(胚状体)的小鼠囊胚样结构。这种结构可使用两种不同的方法获得:通过组装预先建立的干细胞系,或通过分化潜能扩展多能干细胞(EPS)为囊胚样结构。Polo等人提到,尽管小鼠胚状体没有完全的发育潜力,但它们可以在体外模拟小鼠早期发育的几个方面。
吴军对澎湃新闻(www.thepaper.cn)记者表示,早期小鼠人造囊胚的构建是直接将上胚层细胞以及滋养层细胞放在一起共培养,通过特殊的培养条件,使其构建成囊胚结构。“但是在人类细胞中,科学家们经过不断尝试,以三种细胞为来源去构建人类囊胚并不能成功。”
吴军进一步解释,“原因在于,人类胚胎干细胞与小鼠还是有很大差别,在小鼠中,细胞类型比较稳定,但是人类的胚胎干细胞是处于一个不稳定阶段,其细胞类型可以互相转化。”
傅建平等人在观点文中提到,到目前为止,从人类细胞中生成类似的囊胚还没有实现。先前的人类早期发育模型使用的发育上类似于植入后、原肠胚形成前的外胚层细胞的人类干细胞。“尽管它们可以重现植入后人类发育的某些阶段,但它们缺乏与滋养外胚层、内胚细胞或两者都相关的细胞谱系。”
人囊胚模型构建
《自然》发表的这两项最新的研究则首次在体外构建了人类囊胚模型。傅建平等人评价道,这些技术突破的关键有两个方面:首先,使用了人类囊胚中具有代表性谱系的细胞;第二,优化了培养方式。
吴军对澎湃新闻记者表示,人囊胚样结构主要包括三种细胞类型,上胚层细胞、原始内胚层细胞、以及滋养层细胞。如何让这三种类型的细胞,在构建过程中,正确出现在其固定的位置上,是一个难点。
他们提出一个新方案,是否可以以一种细胞类型为起始点,通过让其自我分化与组装,从而构建出具备三种细胞类型的囊胚?
经过测试,吴军等人获得了成功。他们最终采用人初始多能性胚胎干细胞,在一个动态过程中向原始内胚层细胞和滋养层细胞两种细胞进行分化。“而且这个过程其实也更接近胚胎发生过程,是由均质化的细胞、一步步发育成囊胚,而不是由不同细胞去构建。”
吴军表示,这个过程本身就模拟了胚胎早期发育的过程,对于研究人类早期胚胎发育更加具有指导意义。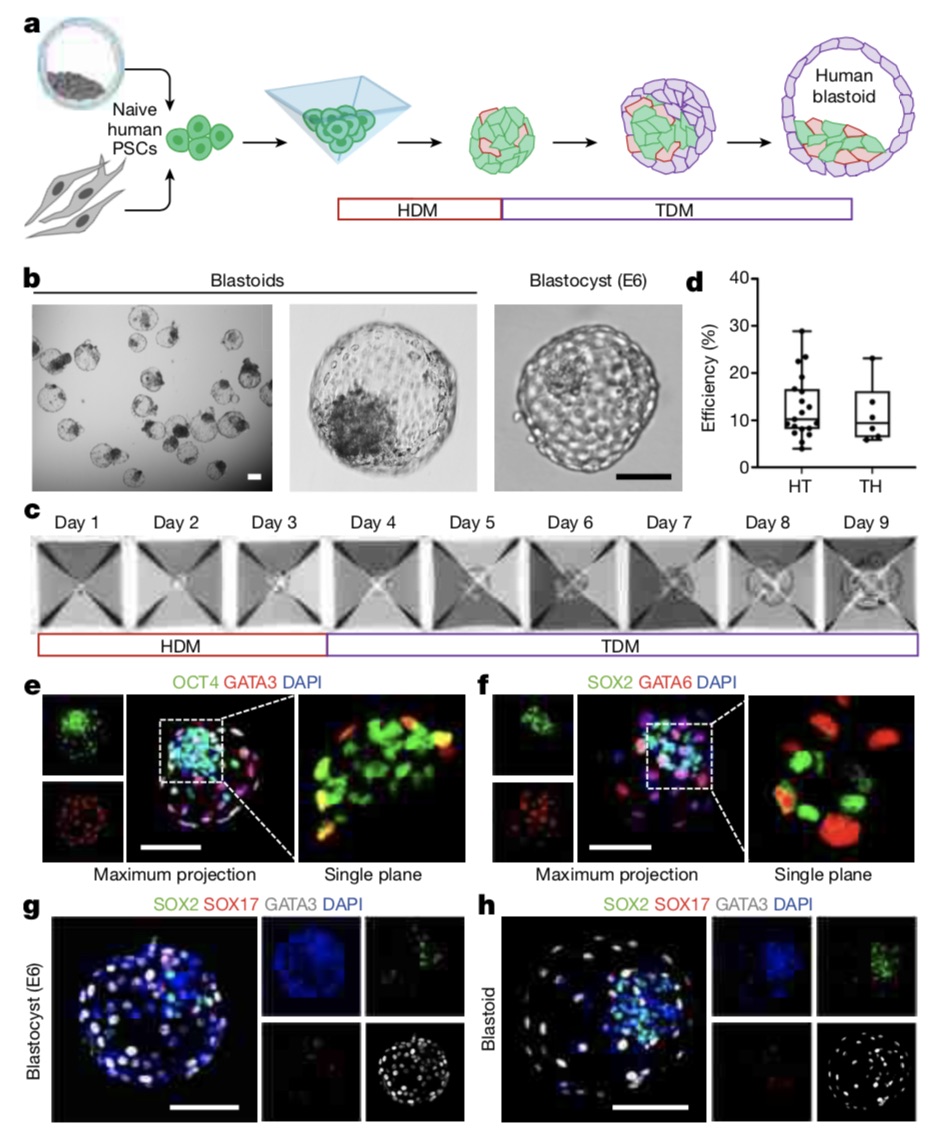
Polo等人在论文中提到,在研究人类重编程中间体时,他们意外地发现这些中间体在聚集时,可以形成空泡细胞结构。为了确定这些结构的真实性质,他们进行了一系列的分子和功能分析。“这些分析表明,该结构是囊胚样结构,可以模拟囊胚生物学的几个方面。”
由于这些结构是由成纤维细胞重编程获得,Polo等人将它们命名为“iBlastoids”(诱导胚状体)。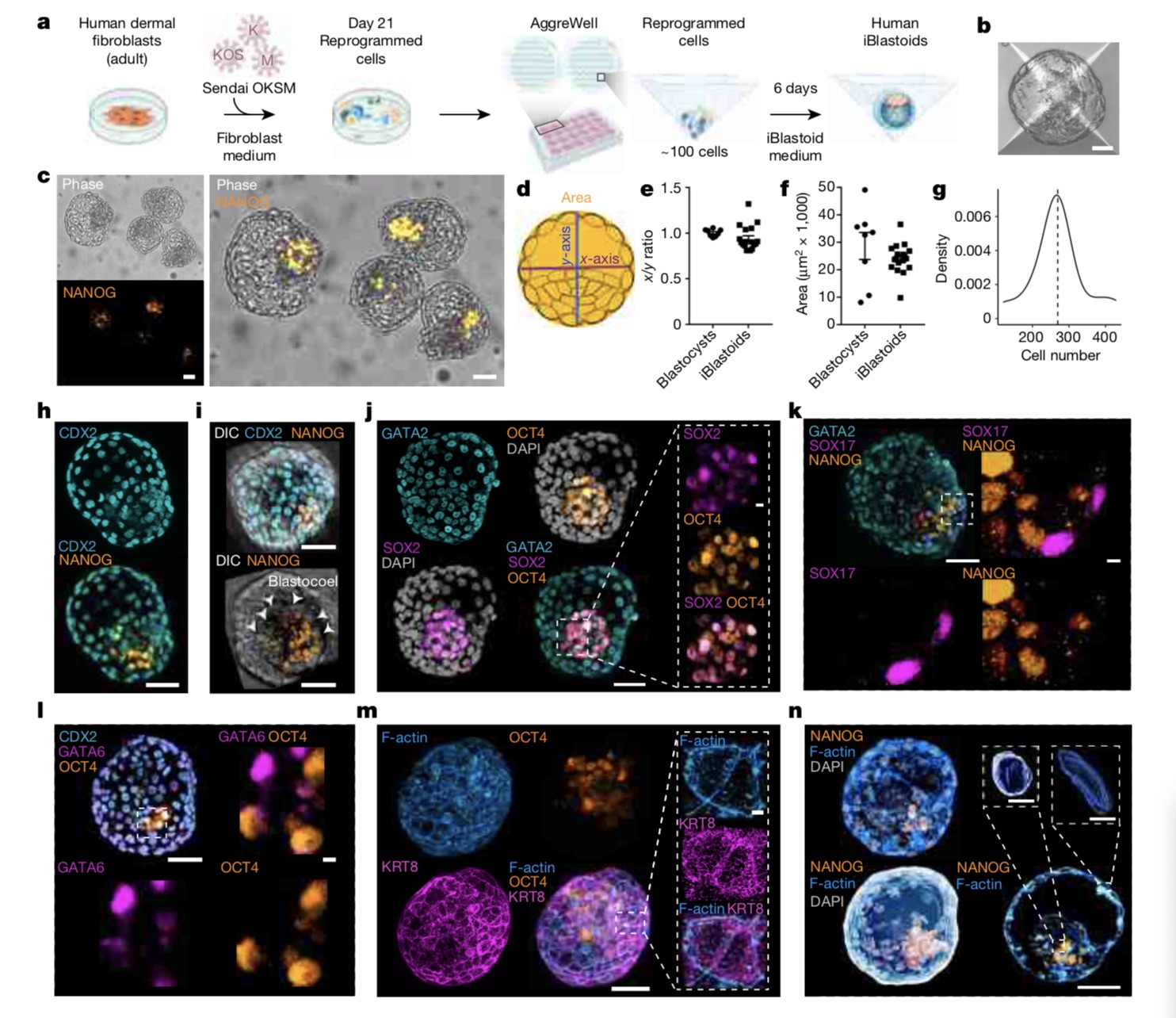
囊胚的详细特征(包括全基因组表达分析和与人类胚胎数据的比较)也表明,它们的细胞谱系与植入前的人类囊胚具有分子相似性。外胚层、滋养外胚层和内胚层相关谱系的空间组织与着床前的人类胚胎一致。
研究团队还证明,获得人囊胚样结构或诱导胚状体具有囊胚谱系的关键特性——分离出来的细胞可用于产生各种类型的干细胞。吴军等人的研究表明,如果将这些干细胞移植到小鼠囊胚中,它们在小鼠胚胎中产生的细胞能够与相应的小鼠谱系整合。
接下来,研究团队还利用一种已建立的模拟在培养皿中植入子宫的实验分析了囊胚的进一步发展。当人囊胚样结构在实验中培养4到5天时,部分会附着在培养皿上继续发育。
在这些附着的囊胚中的一部分,代表外胚层的细胞系组成一个包围着中央空腔的结构,这或对应于着床后囊胚的外胚层中形成的前羊膜腔。在一些人囊胚样结构中,与滋养外胚层相关的细胞谱系分化为特殊的胎盘细胞类型。研究还观察到,一些人囊胚样结构中与内胚层相关的细胞系中存在第二个空腔,类似于卵黄囊空腔。
Polo等人在论文总结部分提到,研究表明,他们的诱导胚状体可以再现人类囊胚的几个方面:第一、诱导胚状体具有滋养外胚层细胞和外胚层细胞,具有空泡,并模拟了人囊胚内细胞类型的空间位置;第二、诱导胚状体在转录上与人囊胚细胞相似;第三、它们还可以在体外模拟人类囊胚的一些关键功能特征。
通过对诱导胚状体生物学三个主要方面的研究,Polo等人认为,诱导胚状体可以作为囊胚的体外模型。
绕不开的伦理争议
值得注意的是,上述两个团队的工作都将引发外界对此类研究生物伦理问题的关注和讨论。
傅建平等人即指出,人囊胚样结构是第一个从体外培养的细胞中衍生出来的人类胚胎模型,它具有胎儿及其支持组织的所有细胞谱系。“随着方案的优化,这些结构将更接近于人类囊胚,这将不可避免地导致生物伦理问题。”
人囊胚样结构的伦理地位应该是怎样的?“14天准则”是否对其适用?傅建平等人强调,对人囊胚样结构进行研究之前,需要回答诸如此类的问题。关于人类胚胎研究的生物伦理,目前国际通用的准则为“14天准则”,即体外研究应在受精后14天结束,这大约是子宫内植入正常完成的时间。
他们写道,对部分人来说,人类囊胚模型的研究在伦理上比天然囊胚的挑战性要小一些,然而,其他人可能认为人类囊胚模型研究是人类胚胎工程的一条道路。
因此,他们呼吁公众就此类研究的科学意义以及由此引发的社会和伦理问题展开讨论。
不过,Polo等人在论文中强调,“它们不应该被认为等同于人类囊胚。例如,它们没有透明带,虽然我们在诱导胚状体的内细胞团中发现了原始内胚层样细胞,但其结构似乎缺乏明确的PE细胞层。此外,诱导胚状体作为模型发育至原始条带形成和原肠胚形成的潜力仍有待确定。”
Polo等人也提到,需要就“14天法则”对诱导胚状体的适用性进行国际讨论。
就此项研究的意义,他们认为,诱导胚状体为模拟胚胎发生过程中早期细胞命运转变提供了一个体外平台。此外,他们希望通过重建滋养外胚层和原始内胚层之间的协调相互作用,来完善现有的认识。
Polo等人还认为,这将允许早期发育疾病的研究和治疗筛选,对理解不孕和早期妊娠失败有巨大的潜力。诱导胚状体也可以作为一个很好的平台进行毒性和病毒易感性筛选,以及使基因治疗技术成为可能。
吴军等人也持类似观点。他对澎湃新闻(www.thepaper.cn)记者表示,“首先,我们必须强调一点,我们研究的并不是真正的胚胎。这个结构只是一种与胚胎具有相似结构的细胞集合体,他并没有生命形成的必须的受精过程,并且目前为止,不能证明该结构具有和胚胎一样具有发育到更复杂胚胎结构的特性,比如产生心肌细胞,神经细胞等等。”
因此,他认为,从生物学角度来看,这个结构的本质并不是胚胎,只是一个可以经历胚胎早期发育过程的胚胎干细胞的集合体。
吴军同时表示,即使在人类胚胎研究的框架下,他们的研究仍旧符合国际上的法律法规以及准则。“法律和国际规范禁止科学家在14天后,或在‘原始条纹’结构出现之后培养人类胚胎,该结构定义了人体主要组织开始形成的时期,且胚胎不能再分裂成同卵双胞胎。我们培养出的人囊胚样结构,相当于胚胎发育的第5-7天,在此基础上,我们让其分化了四天,加起来总共10-11天。”
此外,吴军称,他们使用的细胞系是美国NIH批准的胚胎干细胞系。
“不论从任何层面,我们的研究从法律道德上符合伦理要求。”吴军表示,“更重要的是,通过对囊胚样结构来研究人类早期胚胎的发生和发育,可以不使用真正的人类胚胎来研究,这在一定程度上是对生命的保护。这些研究对解决出生缺陷和人类发展的许多其他重要且未被研究的方面打开了窗口。”(本文来自澎湃新闻,更多原创资讯请下载“澎湃新闻”APP)
北京时间3月18日凌晨,国际顶级学术期刊《自然》(Nature)在线发表了两篇论文,描述了两种在实验室条件下生成的人囊胚样结构。
美国密歇根大学安娜堡分校傅建平等人在《自然》同期刊发的观点文章中点评:“这是第一个完整的人类胚胎模型,含有与胎儿及其支持组织的所有初始细胞谱系相关的细胞类型。”他们认为,利用体外培养的细胞构建哺乳动物胚胎模型技术为探索生命奥秘带来了令人兴奋的机遇。

 两篇论文分别题为“Blastocyst-like structures generated from human pluripotent stem cells” 、“Modelling human blastocysts by reprogramming fibroblasts into iBlastoids”。
两篇论文分别题为“Blastocyst-like structures generated from human pluripotent stem cells” 、“Modelling human blastocysts by reprogramming fibroblasts into iBlastoids”。
第一项研究由美国得克萨斯大学西南医学中心和中国的五邑大学、昆明医科大学等团队的研究人员联合完成,通讯作者为得克萨斯大学西南医学中心助理教授Gary C. Hon和吴军。
第二项研究由澳大利亚莫纳什大学、杜克-新加坡国立大学医学院、美国加州大学洛杉矶分校等团队的研究人员联合完成,通讯作者为莫纳什大学解剖与发育生物学系教授Jose M. Polo。
吴军在接受澎湃新闻(www.thepaer.cn)记者专访时表示,“目前我们对于胚胎发育的了解,大多是还是来自于对各种模式生物的研究,比如小鼠等。这主要是因为两点:一、使用胚胎进行研究,涉及很多伦理问题。二、能够用于研究的人类胚胎主要来自于采取人工授精治疗后的夫妇,将多余的胚胎捐赠用于研究。”
然而,这些稀有的胚胎数量,远远达不到进行深入研究的需求。吴军认为,“如果能够在体外获得一种类似于人类胚胎的结构,这将同时解决上述的两个问题,使科学家们更加广泛深入的研究人类早期胚胎发育变为可能。”
傅建平等人在观点文章中写道:如果我们要改进辅助生殖技术、防止怀孕失败和出生缺陷,对早期人类发育的正确理解是至关重要的。然而,研究早期发育是一个挑战——几乎没有人类胚胎可用,而且研究受到相当大的伦理和法律限制。他们认为上述两项研究在这一领域取得了重大进展。
不过值得注意的是,上述两个研究团队均强调,他们在体外构建的模型“不应该被认为等同于人类囊胚”。吴军对澎湃新闻记者表示,“我们必须强调一点,我们研究的并不是真正的胚胎。”他总结道,从生物学角度,这个结构的本质并不是胚胎,只是一个可以经历胚胎早期发育过程的胚胎干细胞的集合体。
人类早期胚胎发育理解受限
包括人类在内的哺乳动物胚胎的发生始于一个全能受精卵,逐渐发育成桑葚胚,然后形成囊胚。囊胚的外胚层(EPI)细胞将发育为胚体和羊膜,而滋养外胚层(TE)细胞和原始内胚层(PE)细胞则最终分别发育为胎盘和卵黄囊。
Polo等人在论文中提到,科学家在体外培养时,可以用外胚层细胞生成人类胚胎干细胞(hES)。另外,也可以通过转录因子介导将成体细胞重编程成人类诱导多能干细胞(hiPS)细胞。这些多能细胞可以分化成身体的所有细胞类型,并已被用于开发体外模型,以研究早期人类发育。
然而,这些简单的干细胞模型虽然对人类多能性的遗传和表观遗传学提供了前所未有的见解,但它们对发生在囊胚和着床前后的人类胚胎发育过程中复杂的时空分子变化提供的信息有限。
Polo等人提到,目前,研究这一问题的唯一方法是将体外受精后捐赠囊胚的研究信息结合起来。但出于研究目的而使用人类囊胚还存在着很多的伦理、政策和技术限制,“这些限制共同限制了我们对早期人类胚胎发育的理解。”
值得一提的是,此前,已有其他实验室生成了名为“Blastoids”(胚状体)的小鼠囊胚样结构。这种结构可使用两种不同的方法获得:通过组装预先建立的干细胞系,或通过分化潜能扩展多能干细胞(EPS)为囊胚样结构。Polo等人提到,尽管小鼠胚状体没有完全的发育潜力,但它们可以在体外模拟小鼠早期发育的几个方面。
吴军对澎湃新闻(www.thepaper.cn)记者表示,早期小鼠人造囊胚的构建是直接将上胚层细胞以及滋养层细胞放在一起共培养,通过特殊的培养条件,使其构建成囊胚结构。“但是在人类细胞中,科学家们经过不断尝试,以三种细胞为来源去构建人类囊胚并不能成功。”
吴军进一步解释,“原因在于,人类胚胎干细胞与小鼠还是有很大差别,在小鼠中,细胞类型比较稳定,但是人类的胚胎干细胞是处于一个不稳定阶段,其细胞类型可以互相转化。”
傅建平等人在观点文中提到,到目前为止,从人类细胞中生成类似的囊胚还没有实现。先前的人类早期发育模型使用的发育上类似于植入后、原肠胚形成前的外胚层细胞的人类干细胞。“尽管它们可以重现植入后人类发育的某些阶段,但它们缺乏与滋养外胚层、内胚细胞或两者都相关的细胞谱系。”
人囊胚模型构建
《自然》发表的这两项最新的研究则首次在体外构建了人类囊胚模型。傅建平等人评价道,这些技术突破的关键有两个方面:首先,使用了人类囊胚中具有代表性谱系的细胞;第二,优化了培养方式。
吴军对澎湃新闻记者表示,人囊胚样结构主要包括三种细胞类型,上胚层细胞、原始内胚层细胞、以及滋养层细胞。如何让这三种类型的细胞,在构建过程中,正确出现在其固定的位置上,是一个难点。
他们提出一个新方案,是否可以以一种细胞类型为起始点,通过让其自我分化与组装,从而构建出具备三种细胞类型的囊胚?
经过测试,吴军等人获得了成功。他们最终采用人初始多能性胚胎干细胞,在一个动态过程中向原始内胚层细胞和滋养层细胞两种细胞进行分化。“而且这个过程其实也更接近胚胎发生过程,是由均质化的细胞、一步步发育成囊胚,而不是由不同细胞去构建。”
吴军表示,这个过程本身就模拟了胚胎早期发育的过程,对于研究人类早期胚胎发育更加具有指导意义。

吴军等人构建人囊胚样结构。
对比之下,Polo率领的团队对成纤维细胞进行了重编程,形成了一个混合细胞群,其中包含的细胞基因表达谱类似于外胚层细胞、滋养外胚层细胞和内胚层细胞。Polo等人在论文中提到,在研究人类重编程中间体时,他们意外地发现这些中间体在聚集时,可以形成空泡细胞结构。为了确定这些结构的真实性质,他们进行了一系列的分子和功能分析。“这些分析表明,该结构是囊胚样结构,可以模拟囊胚生物学的几个方面。”
由于这些结构是由成纤维细胞重编程获得,Polo等人将它们命名为“iBlastoids”(诱导胚状体)。

Polo等人构建诱导胚状体。
两组研究团队都发现,人囊胚结构在培养6-8天后形成,其形成效率达20%,这与此前小鼠囊胚构建的效率相当。人囊胚的大小和形状与自然囊胚相似,细胞总数也相似。囊胚的详细特征(包括全基因组表达分析和与人类胚胎数据的比较)也表明,它们的细胞谱系与植入前的人类囊胚具有分子相似性。外胚层、滋养外胚层和内胚层相关谱系的空间组织与着床前的人类胚胎一致。
研究团队还证明,获得人囊胚样结构或诱导胚状体具有囊胚谱系的关键特性——分离出来的细胞可用于产生各种类型的干细胞。吴军等人的研究表明,如果将这些干细胞移植到小鼠囊胚中,它们在小鼠胚胎中产生的细胞能够与相应的小鼠谱系整合。
接下来,研究团队还利用一种已建立的模拟在培养皿中植入子宫的实验分析了囊胚的进一步发展。当人囊胚样结构在实验中培养4到5天时,部分会附着在培养皿上继续发育。
在这些附着的囊胚中的一部分,代表外胚层的细胞系组成一个包围着中央空腔的结构,这或对应于着床后囊胚的外胚层中形成的前羊膜腔。在一些人囊胚样结构中,与滋养外胚层相关的细胞谱系分化为特殊的胎盘细胞类型。研究还观察到,一些人囊胚样结构中与内胚层相关的细胞系中存在第二个空腔,类似于卵黄囊空腔。
Polo等人在论文总结部分提到,研究表明,他们的诱导胚状体可以再现人类囊胚的几个方面:第一、诱导胚状体具有滋养外胚层细胞和外胚层细胞,具有空泡,并模拟了人囊胚内细胞类型的空间位置;第二、诱导胚状体在转录上与人囊胚细胞相似;第三、它们还可以在体外模拟人类囊胚的一些关键功能特征。
通过对诱导胚状体生物学三个主要方面的研究,Polo等人认为,诱导胚状体可以作为囊胚的体外模型。
绕不开的伦理争议
值得注意的是,上述两个团队的工作都将引发外界对此类研究生物伦理问题的关注和讨论。
傅建平等人即指出,人囊胚样结构是第一个从体外培养的细胞中衍生出来的人类胚胎模型,它具有胎儿及其支持组织的所有细胞谱系。“随着方案的优化,这些结构将更接近于人类囊胚,这将不可避免地导致生物伦理问题。”
人囊胚样结构的伦理地位应该是怎样的?“14天准则”是否对其适用?傅建平等人强调,对人囊胚样结构进行研究之前,需要回答诸如此类的问题。关于人类胚胎研究的生物伦理,目前国际通用的准则为“14天准则”,即体外研究应在受精后14天结束,这大约是子宫内植入正常完成的时间。
他们写道,对部分人来说,人类囊胚模型的研究在伦理上比天然囊胚的挑战性要小一些,然而,其他人可能认为人类囊胚模型研究是人类胚胎工程的一条道路。
因此,他们呼吁公众就此类研究的科学意义以及由此引发的社会和伦理问题展开讨论。
不过,Polo等人在论文中强调,“它们不应该被认为等同于人类囊胚。例如,它们没有透明带,虽然我们在诱导胚状体的内细胞团中发现了原始内胚层样细胞,但其结构似乎缺乏明确的PE细胞层。此外,诱导胚状体作为模型发育至原始条带形成和原肠胚形成的潜力仍有待确定。”
Polo等人也提到,需要就“14天法则”对诱导胚状体的适用性进行国际讨论。
就此项研究的意义,他们认为,诱导胚状体为模拟胚胎发生过程中早期细胞命运转变提供了一个体外平台。此外,他们希望通过重建滋养外胚层和原始内胚层之间的协调相互作用,来完善现有的认识。
Polo等人还认为,这将允许早期发育疾病的研究和治疗筛选,对理解不孕和早期妊娠失败有巨大的潜力。诱导胚状体也可以作为一个很好的平台进行毒性和病毒易感性筛选,以及使基因治疗技术成为可能。
吴军等人也持类似观点。他对澎湃新闻(www.thepaper.cn)记者表示,“首先,我们必须强调一点,我们研究的并不是真正的胚胎。这个结构只是一种与胚胎具有相似结构的细胞集合体,他并没有生命形成的必须的受精过程,并且目前为止,不能证明该结构具有和胚胎一样具有发育到更复杂胚胎结构的特性,比如产生心肌细胞,神经细胞等等。”
因此,他认为,从生物学角度来看,这个结构的本质并不是胚胎,只是一个可以经历胚胎早期发育过程的胚胎干细胞的集合体。
吴军同时表示,即使在人类胚胎研究的框架下,他们的研究仍旧符合国际上的法律法规以及准则。“法律和国际规范禁止科学家在14天后,或在‘原始条纹’结构出现之后培养人类胚胎,该结构定义了人体主要组织开始形成的时期,且胚胎不能再分裂成同卵双胞胎。我们培养出的人囊胚样结构,相当于胚胎发育的第5-7天,在此基础上,我们让其分化了四天,加起来总共10-11天。”
此外,吴军称,他们使用的细胞系是美国NIH批准的胚胎干细胞系。
“不论从任何层面,我们的研究从法律道德上符合伦理要求。”吴军表示,“更重要的是,通过对囊胚样结构来研究人类早期胚胎的发生和发育,可以不使用真正的人类胚胎来研究,这在一定程度上是对生命的保护。这些研究对解决出生缺陷和人类发展的许多其他重要且未被研究的方面打开了窗口。”(本文来自澎湃新闻,更多原创资讯请下载“澎湃新闻”APP)











